Virale Proteaseinhibitoren durch fragmentbasiertes Design
Virale Proteasen spalten das virale Polyprotein und stellen damit einen universellen Angriffspunkt zur Hemmung der viralen Replikation dar. Die große Herausforderung ist die Selektivität potenzieller Hemmstoffe gegenüber humanen Proteasen, die durch computergestütztes Wirkstoffdesign gut adressiert werden kann. In einer virtuellen Screening-Kampagne konnten über strukturbasiertes Design flavivirale NS2B-NS3-Proteaseinhibitoren gefunden werden (IC50 0.09 µM für die Dengue NS2B-NS3 Protease, ACS Med. Chem. Lett., 11:514-520, 2020).
Proteasen bieten die Möglichkeit, chemisch neue Ansätze zu verfolgen, da die Selektivität über systematisches fragmentbasiertes Design erreicht werden kann. Hier werden in einem ersten Schritt (kovalent) bindende Fragmente identifiziert, die dann strukturbasiert im Computermodell erweitert werden. Da die Bindung des Initialfragments massenspektrometrisch validiert werden kann, ist dieser Ansatz ideal für eine experimentell gesteuerte, rationale strukturbasierte Entwicklung neuer Liganden. Für die enterovirale 3C-Protease (3CPro) konnten wir Phenylthiomethylketon-basierte kleine Fragmente identifizieren, die kovalent und selektiv binden. Computergestützt wurde das initial identifizierte Fragment erweitert, wodurch die Aktivität wie vorhergesagt verbessert werden konnte (J. Med. Chem., 61:1218-1230, 2018).
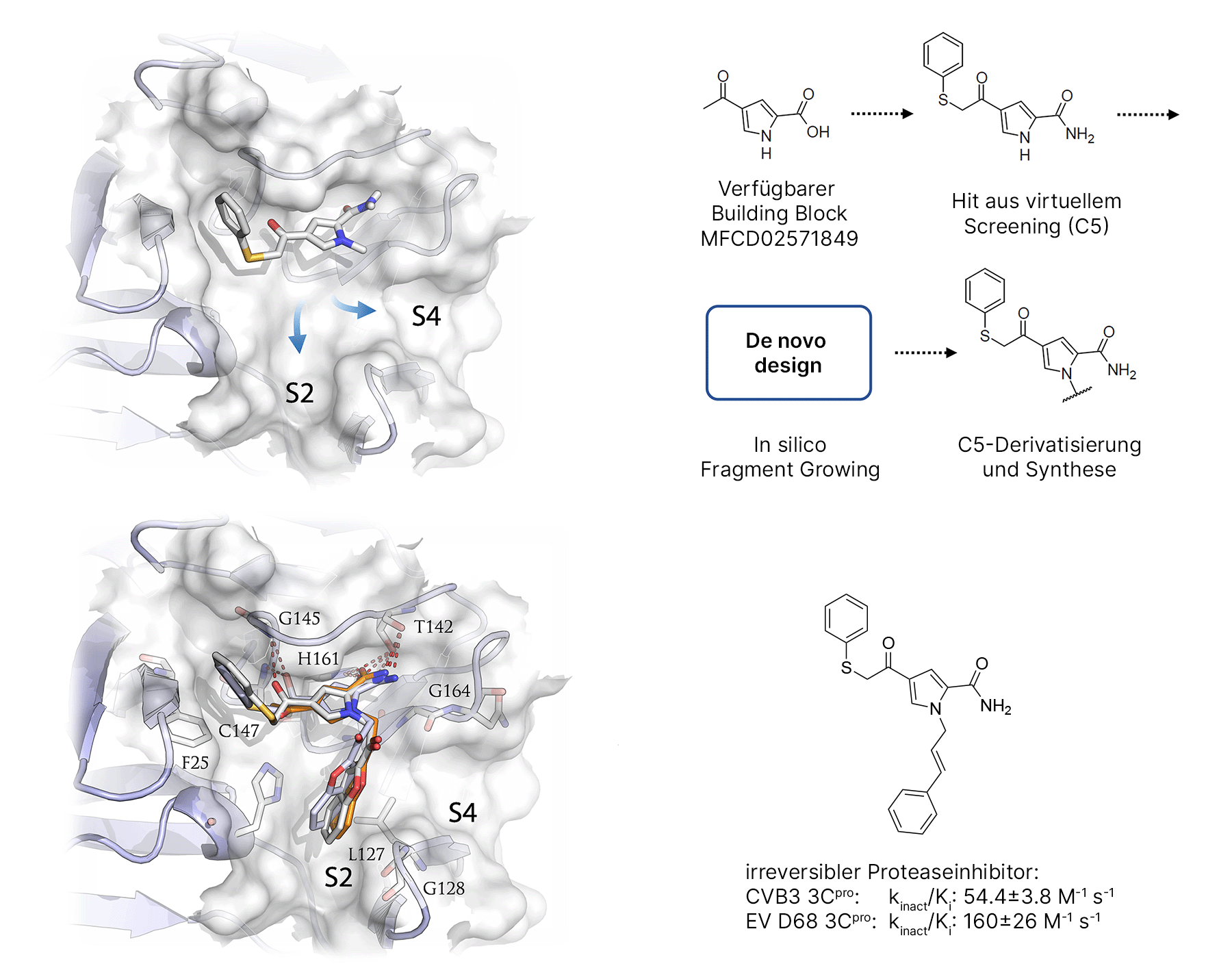
Abb.: Fragmentbasierte Designstrategie für irreversible Liganden der viralen 3Cpro. Links oben: initialer Hit mit Exitvektoren in die S3- und S4-Bindetasche. Rechts oben: Ausgangsfragment für die Synthese der Derivate. Unten: irreversibler Inhibitor
Links:
- S. Pach, T. M. Sarter, R. Yousef, D. Schaller, S. Bergemann, C. Arkona, J. Rademann, C. Nitsche, and G. Wolber. Catching a moving target: comparative modeling of flaviviral NS2B-NS3 reveals small molecule Zika protease inhibitors, ACS Medicinal Chemistry Letters, 11(4):514-520, 2020 [doi:10.1021/acsmedchemlett.9b00629].
- R. Schulz, A. Atef, D. Becker, F. Gottschalk, C. Tauber, S. Wagner, C. Arkona, A. A. Abdel-Hafez, H. H. Farag, J. Rademann, and G. Wolber. Phenylthiomethyl ketone-based fragments show selective and irreversible inhibition of enteroviral 3C proteases, J Med Chem, 61(3):1218-1230, 2018 [doi:10.1021/acs.jmedchem.7b01440].
- D. Becker, Z. Kaczmarska, C. Arkona, R. Schulz, C. Tauber, G. Wolber, R. Hilgenfeld, M. Coll, and J. Rademann. Irreversible inhibitors of the 3C protease of Coxsackie virus through templated assembly of protein-binding fragments, Nat Commun, 7:12761, 2016 [doi:10.1038/ncomms12761].