Toll-like-Rezeptoren: Modulation der angeborenen Immunantwort zur Inflammationsregulierung und Krebstherapie
Der Grad der TLR-Dimerisiserung reguliert Inflammation und Immunantwort. Wir entwickeln Liganden, die das Ausmaß der DImerisierung und damit die Immunantwort gezielt beinflussen können.
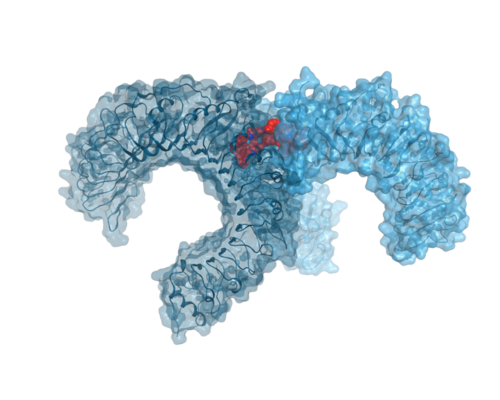
Toll-like-Rezeptoren (TLRs) bilden die erste Barriere bei der angeborenen Immunantwort und stellen daher ein hochinteressantes und therapeutisch vielversprechendes Target dar, um die Immunantwort und Inflammation zu modulieren. TLRs erkennen pathogenassoziierte molekulare Muster (engl. pathogen associated molecular patterns – PAMPs) eindringender Mikroorganismen, die es dem Wirt ermöglichen, zwischen verschiedenen Infektionen zu unterscheiden. Neben PAMPs können auch durch Stress oder Verletzung freigesetzte Moleküle, sogenannte schädigungs- oder gefahrassoziierte molekulare Muster (engl. danger associated molecular patterns – DAMPs), von TLRs erfasst werden. Mechanistisch gesehen aktivieren sich TLRs durch Dimerisierung und lösen durch anschließende Konformationsänderung intrazelluläre Signalkaskaden aus, die inflammatorische Prozesse starten.
In unseren Arbeiten haben wir sowohl niedermolekulare TLR-Agonisten als auch Antagonisten mithilfe einer Kombination aus rationalem, rechnergestütztem Design und virtuellem Screening erfolgreich identifiziert (ChemMedChem, 9:813-822, 2014, ChemMedChem, 15: 1364-1371, 2020, Biochem. Pharmacol., 154: 148-160, 2018). Die chemische Optimierung und anschließende umfassende pharmakologische Charakterisierung dieser Verbindungen zeigten, dass nur geringfügige Unterschiede bei der Beeinflussung der Dimerisierungskonformationen differenzierte intrazelluläre Signale auslösen. Hier zeigen die von uns entwickelten Liganden neue Interaktionsmuster im Vergleich zu bekannten Verbindungen (z. B. CU-CPT22, Biochem. Pharmacol., 171:113687, 2020). Es gibt immer noch Lücken beim Verständnis der TLR-Funktion, insbesondere die Dynamik des nachgeschalteten TLR-Signaling bleibt weiterhin ein interessantes Forschungsgebiet.
Wir bedanken uns für finanzielle Unterstützung dieses Forschungsbereichs bei: