Cytochrom P450 Enzyme: Metabolismus & Anwendungen in der Krebstherapie
Das Verständnis des menschlichen Metabolismus ist ein wesentlicher Aspekt des modernen Wirkstoffdesigns. Da sich die Forschung in diesem Bereich primär auf 3A4, 2C9 und 2D6 fokussiert, sind viele der 57 funktionalen humanen CYP-Enzyme noch weitestgehend uncharakterisiert. Dieses bisher kaum bearbeitete Feld bietet für die Arzneistoffentwicklung viele interessante Möglichkeiten (Drug Discov. Today, 26:2456-2464, 2021). So konnten wir in Kooperation mit Prof. Parr substanziell zum Verständnis des CYP-mediierten Steroidmetabolismus beitragen, neue Abbauwege von Olanzapin (3A43) zeigen und durch Polymorphismen induzierte verschiedene Metaboliten von Alprazolam mechanistisch erklären (Front. Endocrinol., 12:633785, 2021, Biomedicines, 10:3022, 2022; Xenobiotica, 52:413–425, 2022).
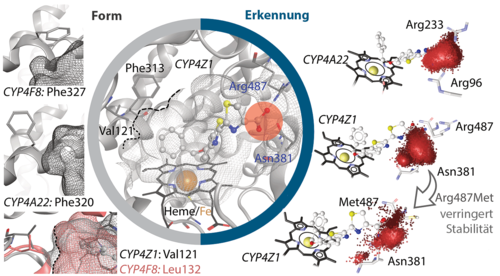
Ein erstes erfolgreiches Targeting eines wenig beachteten Cytochrom P450 Enzyms konnten wir an CYP4Z1 realisieren: CYP4Z1 wird in Brustkrebsgewebe überexprimiert und seine Immunreaktivität wird mit primärem Eierstockkrebs assoziiert. Wir konnten erstmals zeigen, dass CYP4Z1 die Hydroxylierung von Laurinsäure und Myristinsäure an vier verschiedenen Positionen katalysieren kann. Unabhängig von seiner natürlichen Funktion macht die starke Überexpression CYP4Z1 bei bestimmten Neoplasien zu einem möglichen Target für eine Prodrug-Strategie zur Heilung von Brustkrebs und anderen CYP4Z1-positiven Tumoren. Durch extensive Homologiemodellierung in Kombination mit Molekulardynamiksimulationen konnten wir die Katalyse von Proluciferin-Substraten in einem ersten Schritt erklären (Biochem. Pharmacol., 146:174-187, 2017). Unsere Simulationen konnten Aktivitätsunterschiede bei Mutationen erklären, führten zur Entdeckung der Schlüsselrolle von Arg487 und wiesen auf die Unterstützung durch Asn381 hin, die in vitro bestätigt wurde. Die Daten legen nahe, dass CYP4Z1-Substrate von Arg487 rekrutiert und von Asn381 und Arg487 fixiert werden (Biochem. Pharmacol., 174:113850, 2020). Mit diesem iterativ in silico und in vitro validierten Modell konnte ein neuer CYP4Z1-Inhibitor mit nanomolarer Aktivität entwickelt werden (Eur. J. Med. Chem., 215:113255, 2021).
WIr bedanken uns für finanzielle Unterstützung dieses Forschungsbereichs bei: