Team Rost
Das Thema umfasst die Synthese und Charakterisierung niederkoordinierter Alkalimetallchalkogenidometallate der Form Ax[MyChz] (A = Li-K, M = Fe, Hg, Ch = O, S). Literaturbekannte Alkalimetalloxidoferrate weisen Strukturen mit einer isolierten oder verknüpften tetraedrischen Koordination der Eisen(III)-Kationen durch die Sauerstoff-Anionen auf (Abbildung 1).[1,2] Hingegen wird bei Alkalimetallchalkogenidomerkuraten eine hantelförmige Koordination des Quecksilber(II)-Kations durch die Sauerstoff-Anionen beobachtet (Abbildung 1).[3]
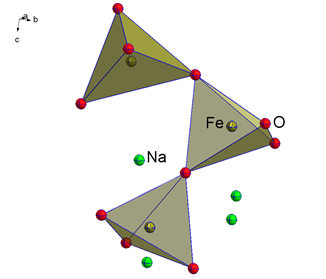
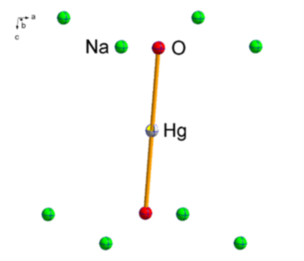
Abbildung 1: Ausschnitt aus der Kristallstruktur von Na4[Fe2O5] mit verknüpften [FeO4]−-Tetraedern (links) und Ausschnitt aus der Kristallstruktur von Na2[HgO2]mit hantelförmig-koordinierten Quecksilber(II)-Kationen (rechts).[3,4] Thermische Ellipsoide sind mit einer Aufenthaltswahrscheinlichkeit von 70 % abgebildet.
Einer unserer Ziele beschreibt die Isolierung niederkoordinierter Alkalimetalloxidoferrate, die Eisen(I)- und Eisen(II)-Kationen in linearer, respektive trigonal planarer, Koordination enthalten. Bislang liegt jeweils eine literaturbekannte Verbindung dieser Spezies vor.[5,6] Als Edukte werden in der Regel die gediegenen Elemente oder die Metalloxide eingesetzt (Schema 1).
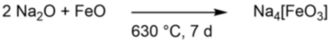
Schema 1: Reaktion von Natriumoxid mit Eisen(II)oxid („Wüstit“) im Hochtemperaturofen.
Unsere primäre Synthesemethode umfasst Hochtemperatursynthesen von Feststoffen. Bei luftstabilen Verbindungen werden die Reaktionen in Korundtiegeln in Hochtemperaturöfen durchgeführt. Für Ofenreaktionen unter inerten Bedingungen verwenden wir Quarzrohre, gegebenenfalls mit Stahlautoklaven. Die Dauer von Festkörperreaktionen im Ofen liegt im Bereich von Stunden bis zu mehreren Wochen. Für schnellere Umsetzungen mit Reaktionszeiten von 3-20 Minuten verwenden wir einen Methansauerstoffhandbrenner um Verbindungen in Quarzampullen auf bis 1400 °C zu erhitzen.
Die Verbindungen werden bei Temperaturen von 120-180 °C und leicht erhöhten Drücken solvothermal umkristallisiert oder mit z.B. Ammoniumsalzen umgesetzt. Ziel dieser Metathesereaktion ist der Austausch der Alkalimetallionen durch sterisch anspruchsvolle, asymmetrische, organische Kationen, in der Hoffnung somit die Löslichkeit des Chalkogenidometallats in organischen Lösungsmitteln zu steigern (Schema 2). Des Weiteren werden die Löslichkeiten unserer Verbindungen in eutektischen Lösungsmitteln untersucht.

Schema 2: Metathesereaktion von Natriummerkurat(II) und Tetraethylammoniumchlorid.
Hauptanalytikmethode zum Nachweis der Reaktionsprodukte ist die Röntgendiffraktometrie am Einkristall oder am Pulver. Hiermit können zum einen Strukturen neuer Verbindungen charakterisiert werden (Messungen am Einkristall), und zum anderen die Reinheiten unserer Verbindungen evaluiert werden (Messungen am Pulver).
Weiterführende Charakterisierungsmethoden schließen die Untersuchung der optoelektrischen Eigenschaften der Verbindungen, beispielsweise durch UV/Vis-, IR- oder Ramanspektroskopie, mit ein.
[1] G. Brachtel, R. Hoppe, Z. Anorg. Allg. Chem. 1978, 446, 87.
[2] G. Brachtel, R. Hoppe, Z. Anorg. Allg. Chem. 1978, 446, 77.
[3] G. Brachtel, R. Hoppe, Naturwissenschaften 1977, 64, 271.
[4] R. Hoppe, H.-J. Röhrborn, Z. Anorg. Allg. Chem. 1964, 329, 110.
[5] F. Bernhardt, R. Hoppe, Z. Anorg. Allg. Chem. 1993, 619, 969.
[6] R. Hoppe, H. Rieck, Z. Anorg. Allg. Chem. 1977, 437, 95.
Schlagwörter
- Alkalimetall
- Bismut
- Eisen
- Nickel
- niedervalente Chalkogenidometallate
- Reduktion
- Schwefel