Team Ionics
Das Projekt konzentriert sich unter anderem auf Reaktivitätsstudien ternärer Phasen neuer niedervalenter Metallate, wie Lithate, Ferrate oder Bismutate, unter Verwendung ionischer Flüssigkeiten als Lösungsmittel. Imidazolium Salze, wie z.B. das 1-Butyl-3-methylimidazoliumchlorid (BMIMCl) (Schema 1), gehören zu dieser Verbindungsklasse und werden bei uns als ionische Flüssigkeit eingesetzt.
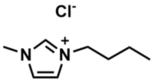
Schema 1: 1-Butyl-3-methylimidazoliumchlorid (BMIMCl) als Beispiel einer ionischen Flüssigkeit.
Das hohe Löslichkeitsvermögen ionischer Flüssigkeiten ermöglicht es eine Vielzahl von Verbindungen, die in gängigen Lösungsmitteln schwer bis nicht-löslich sind, in Lösung zu bringen.[1] Die chemischen Eigenschaften dieser polaren, jedoch nicht-koordinierenden Lösungsmittel, können sowohl organische, als auch anorganische Stoffe lösen, wodurch die Auswahl potentieller Kombinationen von Reaktanden bedeutend erweitert wird.
Klassische Festkörpersynthesen erfordern hohe Temperaturen und lange Reaktionszeiten, und resultieren zumeist in der Bildung des thermodynamischen Reaktionsprodukts. Aufgrund der speziellen Eigenschaften ionischer Flüssigkeiten und unter Verwendung von Auxiliaren, z.B. weiterer Salze oder Elemente, können die Synthesen bei entschieden milderen Reaktionsbedingungen durchgeführt werden, wodurch die kinetischen Produkte zugänglich werden.[2]
Alkali- und Erdalkalimetallate gehören zu entsprechend synthetisierten Verbindungsklassen. Ein Beispiel solch einer Verbindung ist das Tetramethylammoniumdichloridolithat(I), das durch die Reaktion von Lithiumchlorid mit Tetramethylammoniumchlorid dargestellt wird (Schema 2). Abbildung 1 zeigt die Kristallstruktur der Verbindung im Festkörper in welcher die Lithium-Kationen tetraedrisch von den Chloridionen koordiniert werden.
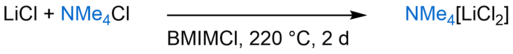
Schema 2: Darstellung von Tetramethylammoniumdichloridolithat(I).
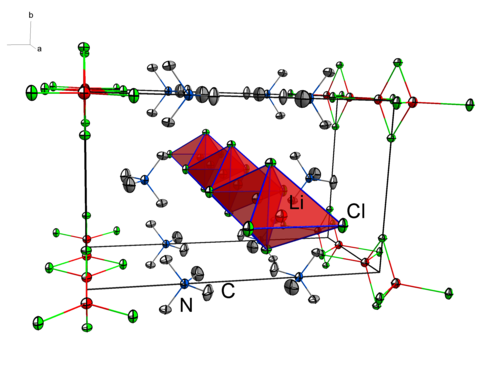
Abbildung 1: Ausschnitt aus der Kristallstruktur von NMe4[LiCl2]. Berechnete Wasserstoffatome sind der Übersichtlichkeit halber ausgeblendet. Thermische Ellipsoide sind mit einer Aufenthaltswahrscheinlichkeit von 70 % abgebildet.
Die Reaktivität binärer und ternärer Phasen, die in gängigen Lösungsmitteln oftmals unlöslich sind, untersuchen wir weiterhin in sogenannten stark eutektischen Lösungsmitteln. Durch das kennzeichnend hohe Löslichkeitsvermögen dieser Lösungsmittel, kann das als unlöslich geltende binäre Oxid, Zink(II)oxid, in Lösung gebracht werden.[3,4]
Stark eutektische Lösungsmittel (engl.: deep eutectic solvents) sind eutektische Salzschmelzen, die aus zwei Komponenten bestehen: einem quaternären Ammoniumsalz, z.B. Cholinchlorid oder Tetraethylammoniumchlorid, und einem Wasserstoffbrückenbindungsdonor (HBD), oftmals Harnstoff.[5] Eutektische Lösungsmittel ähneln in ihren physikalisch-chemischen Eigenschaften den ionischen Flüssigkeiten, sind jedoch leichter darstellbar und biologisch weniger bedenklich.[6]
Hauptanalytikmethode zum Nachweis der Reaktionsprodukte ist die Röntgendiffraktometrie am Einkristall oder am Pulver. Hiermit können zum einen Strukturen neuer Verbindungen charakterisiert werden (Messungen am Einkristall), und zum anderen die Reinheiten unserer Verbindungen evaluiert werden (Messungen am Pulver). Weiterführende Charakterisierungsmethoden schließen Schwingungsspektroskopische Untersuchungen, wie IR- oder Ramanspektroskopie, mit ein.
[1] R. E. Morris, Chem. Commun. 2009, 2990.
[2] H. D. B. Jenkins, Sci. Prog. 2011, 94, 265.
[3] X. Wang, C. Xu, H. Liu, M Huang, X. Ren, S. Wang, Y. Hua, Q. B. Zhang, J. Ru, Ionics 2020, 26, 1483.
[4] X. L. Zu, C. Xu, J. Tang, Y. Hua, Q. Zhang, H. Liu, X. Wang, M. Huang, T. Nonferr. Metal. Soc. 2019, 29, 2222.
[5] A. P. Abbott, G. Capper, D. L. Davies, R. K. Rasheed, V. Tambyrajah, Chem. Commun. 2003, 70.
[6] G. Carrasco-Huertas, R. J. Jiménez-Riobóo, M. C. Gutiérrez, M. L. Ferrer, F. Del Monte, Chem. Commun. 2020, 56, 3592.
Schlagwörter
- Alkalat
- Auxiliar
- Ionische Flüssigkeit
- Metallate