Team Elektride
Das Thema der Elektride befasst sich mit der Solvatisierung und Stabilisierung von Elektronen in primären Aminen. Alkalimetalle, wie Natrium und Kalium, werden oxidiert, während die korrespondierenden Elektronen unter einer charakteristischen Blaufärbung vom Lösungsmittel, z.B. Ammoniak, stabilisiert werden (Schema 1).[1,2].
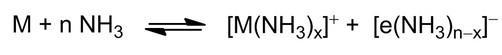
Schema 1: Solvatisierung von Alkalimetallkationen und Elektronen in flüssigem Ammoniak.
Nackte Elektronen gehören zu den stärksten Reduktionsmitteln und weisen somit beispiellose Reaktivitäten auf. Elektride können zur Bildung neuartiger Metallide (Metalle in negativen Oxidationsstufen) oder zur Reduktion von Verbindungen, die als unreaktiv gelten, eingesetzt werden. [Cs(18C6)2]e− (18C6 = 18-Krone-6) wurde als erstes kristallines Elektrid isoliert, weitere Elektridverbindungen mit Komplexbildnern wurden ebenfalls kristallographisch charakterisiert.[3,4] In analoger Weise wurden bereits Alkalidsalze synthetisiert und kristallisiert, wie etwa das erste Alkalid [Na(C222)]Na (C222 = [2.2.2]Kryptand).[5,6]
Eins unserer Ziele ist die Synthese und Kristallisierung metallfreier Elektride. Als potentielle Kationen für die Metathesereaktion, untersuchen wir unter anderem Tetraalkylammonium-Salze (Schema 2). Neben dem Lösen von Alkalimetallen als Elektronenquelle, stellt die Elektrolyse in primären Aminen einen weiteren Ansatz für die Synthese von Elektridlösungen dar.
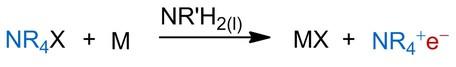
Schema 2: Metathesereaktion von Tetraalkylammonium-Salzen und Alkalimetallen zur Bildung von Elektriden.
Abbildung 1 zeigt ein Reaktionsgemisch mit der charakteristischen tiefblauen Färbung und dem metallischen Glanz der Elektridlösung, sowie einer Dendritenbildung an der Kolbenwand.

Abbildung 1: Elektridreaktionsgemisch mit Dendritenbildung am Kolbenrand.
Bei der Elektridsynthese können viele Parameter variiert werden, es gilt dabei die idealen Bedingungen zur Stabilisierung der Elektronen zu finden. Folgende Techniken stehen dabei im Vordergrund: Trocknen von Lösungsmitteln und Salzen, Arbeiten bei Temperaturen von −30 - −90 °C, Arbeiten mit verflüssigten Gasen und Arbeiten unter strengen Inertbedingungen.
Die Charakterisierung der Reaktionsprodukte erfolgt zumeist über Pulver- oder Einkristalldiffraktometrie, jedoch können ebenfalls weitere gängige Nachweismethoden wie NMR-, ESR-Spektroskopie oder eine Elementaranalyse verfolgt werden.
[1] J. L. Dye, Phil. Trans. R. Soc. A 373: 20140174.
[2] J. L. Dye, Science 2003, 301, 607.
[3] J. M. Ceraso, M. Tak Lok, B. L. Barnett, F. J. Tehan, J. L. Dye, J. Am. Chem. Soc.1974, 96, 608.
[4] B. Van Eck, L. Dinh Le, D. Issa, J. L. Dye, Inorg. Chem. 1982, 21, 1966.
[5] F. J. Tehan, B. L. Barnett, J. L. Dye, J. Am. Chem. Soc. 1974, 96, 7203.
[6] S. B. Dawes, D. L. Ward, R. He Huang, J. L. Dye, J. Am. Chem. Soc. 1986, 108, 3534.
Schlagwörter
- Elektride
- Reduktion