ON-TARGET Studie

Nicht-interventionelle Studie zum Therapeutischen Drug Monitoring (TDM) bei Patienten mit Nierenzellkarzinom sowie zur Untersuchung der Praxistauglichkeit der VAMS-Technologie für die Probengewinnung
Aktuelles:
- Eine aktuelle Zusammenfassung der ON-TARGET Studie "One dose to treat them all? – Therapeutisches Drug Monitoring zur Dosisoptimierung in der oralen Antitumortherapie" ist in der deutschen Fachzeitschrift Best Practice Onkologie erschienen (Link)
- Publikation des ON-TARGET Protokoll-Papers "Developing a Nationwide Infrastructure for Therapeutic Drug Monitoring of Targeted Oral Anticancer Drugs: The ON-TARGET Study Protocol" in der Fachzeitschrift Cancers (Link)
- ON-TARGET gewinnt den Lesmüller-Posterpreis für die beste Poster-Präsentation in der Kategorie "Klinische Pharmazie" bei der Jahrestagung der Deutschen Pharmazeutischen Gesellschaft e.V. (Link)
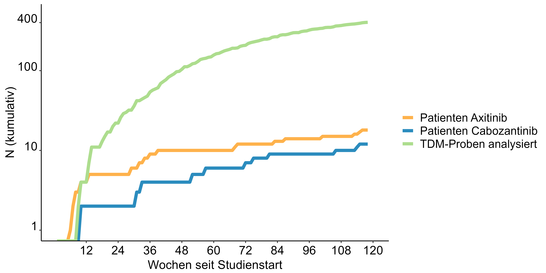
Anzahl der bereits eingeschlossenen Patienten seit Studienstart
Hintergrund
Die Therapie mit innovativen zielgerichteten Arzneimitteln in Tablettenform hat die Prognose von Tumorerkrankungen vielfach in hohem Maße verbessert und zudem die Lebensqualität im Vergleich zu einer klassischen Chemotherapie gesteigert.
Diesen Vorteilen stehen jedoch oft komplexe Einnahmeschemata, ein hohes Wechselwirkungspotenzial und eine hohe pharmakokinetische Variabilität der Tumortherapeutika gegenüber.
Dies bedeutet, dass trotz Einnahme gleicher Dosen große Unterschiede in den Arzneistoffkonzentrationen einzelner Patienten auftreten können.
Da gegenwärtig alle Patienten die gleiche Dosis erhalten, liegen aufgrund der oben genannten Gründe häufig entweder zu hohe oder zu niedrige Arzneistoffkonzentrationen vor, was zu vermehrten unerwünschten Arzneimittelwirkungen oder Wirkungsminderung führen kann.

Abbildung modiziert von Groenland et al. (2019)
Ziel der Studie
Eine routinemäßige Bestimmung der Arzneistoffkonzentrationen im Blut als Therapiestandard bietet die Möglichkeit, bei Patient*innen gemessene Arzneistoffkonzentrationen im Rahmen eines Therapeutischen Drug Monitorings (TDM) mit therapeutischen Zielbereichen zu vergleichen.
Bei einem TDM kann auf Grundlage von gemessenen Konzentrationen des Arzneistoffs die Dosierung des Medikaments individuell auf den/die Patient*in zugeschnitten werden. Bei den in dieser Studie untersuchten Arzneimitteln stehen vor allem die unerwünschten Arzneimittelwirkungen im Vordergrund. Durch die Messung der Arzneistoffkonzentrationen im Blut kann frühzeitig die Wahrscheinlichkeit für starke unerwünschte Arzneimittelwirkungen abgeschätzt und dementsprechend die Therapie angepasst werden. Dafür werden Arzneistoffkonzentrations-Schwellenwerte genutzt, die in klinischen Studien mit einem erhöhten Auftreten von unerwünschten Arzneimittelwirkungen in Zusammenhang gebracht wurden. Gleichzeitig soll untersucht werden, ob die routinemäßige Messung der Konzentration von krankheitsspezifischen körpereigenen Proteinen, sogenannten Biomarkern, eine frühe Abschätzung der zu erwartenden unerwünschten Arzneimittelwirkungen ermöglicht.
Als weiteres Studienziel soll die Praxistauglichkeit des Volumetrischen Absorptiven MicroSamplings (VAMS) für die TDM-Probengewinnung untersucht werden. Für die minimal-invasive VAMS-Technologie werden anstatt einer venösen Blutprobe nur wenige Bluttropfen aus der Fingerbeere wie bei einer Blutzuckermessung benötigt. Durch die unkomplizierte Probensammlung und den normalen postalischen Versand der VAMS-Blutprobe an unser Studienlabor können somit Patienten ihre Probe in der Sekundärphase der Studie selbst im häuslichen Umfeld gewinnen und diese verschicken.
Insgesamt soll diese Studie die Grundlagen erarbeiten, flächendeckend eine Infrastruktur für die Durchführung eines routinemäßigen TDM bei Patienten unter oraler Tumortherapie zu entwickeln.
Studienablauf
Der/die behandelnde Ärzt*in entscheidet über:
- die Behandlung, d.h. Auswahl und Dosierung von Axitinib und Cabozantinib
- Notwendigkeit der Durchführung eines routinemäßigen TDMs unter Therapie mit Axitinib und Cabozantinib
- Falls Einverständnis vorliegt: Einschluss von Patient*innen in diese Studie (unabhängig von der Durchführung des TDMs)
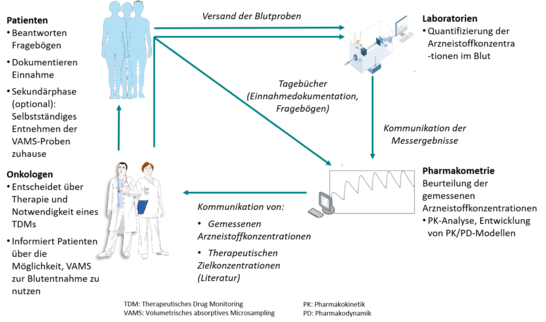
Abbildung erstellt mit Servier Smart Medical Art
Primär- und Sekundärphase
Primärphase:
- Abnahme von venösem und kapillärem Blut (mittels VAMS)
- Bestimmung eines Umrechnungsfaktors (kapillär-venös)
- 2 Probenpaare pro Patient*in angestrebt
Sekundärphase:
- Entnahme von TDM-Proben bei Kontrollterminen (venös oder kapillär) oder zuhause (kapillär)