Stöchiometrie
Stellen Sie sich auch bei den weiteren Überlegungen die stöchiometrisch reagierenden Moleküle vor!
Man benötigt dazu als erstes die stöchiometrische Reaktionsgleichung:
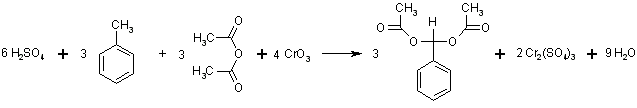
Es reagieren also:
 |
 |
 |
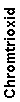 |
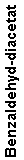 |
||
| Moleküle | 6 | 3 | 3 | 4 | zu | 3 |
| Also auch Mole | 6 | 3 | 3 | 4 | zu | 3 |
| Wenn man die Molzahlen durch die stöchiometrischen Koeffizienten teilt, erhät man Äquivalente. | ||||||
| Äquivalente | 6:6=1 | 3:3=1 | 3:3=1 | 4:4=1 | 3:3=1 | |
Die letzte Zeile sieht ziemlich banal aus, weil überall 1 herauskommt.
Bedenken Sie, dass das ein Idealfall ist, bei dem
- alle Moleküle im exakten stöchiometrischen Verhältnis eingesetzt werden
- jedes Molekül vollständig abreagiert und
- ausschließlich das gewünschte Produkt - und zwar zu 100 % gebildet wird.
Bei realen Versuchsansätzen
- werden Reaktanden oft nicht in exakt stöchiometrischem Verhältnis eingesetzt, z.B. weil man durch Überschuss des einen Reaktanden die Ausbeute hinsichtlich des anderen Reaktanden verbessern will
- werden nicht 100 % Produktausbeute erhalten.
Bei einem realen Versuchsansatz gilt es also, zuerst die limitierende Komponente zu bestimmen.
Das ist die unterschüssig eingesetzte Komponente. Machen Sie sich klar:
- Wenn alle Moleküle der unterschüssig eingesetzten Komponente reagiert haben, kann kein weiteres Produkt mehr gebildet werden - auch wenn Tonnen der anderen Reaktionspartner noch auf eine Reaktion warten.
Es wäre ein Fehler, die Ausbeute einer Reaktion immer auf das eingesetzte organische Substrat zu beziehen, bloß weil es sich um ein organisch-chemisches Praktikum handelt. Es ist zwar häufig so, dass die Reagenzien zur Umwandlung eines organischen Substrats überschüssig eingesetzt werden, aber das muss keineswegs immer der Fall sein.

