Ausblick
Denkweisen außerhalb des akademischen Elfenbeinturms
Aus akademischer Sicht zählt grundsätzlich nur die Ausbeute bezogen auf die Menge des eingesetzten Edukts. Eine hohe Ausbeute ist ein Hinweis auf eine glatt verlaufende Reaktion, die das Substrat "gut übersteht" ohne sich zu zersetzen oder Nebenreaktionen einzugehen. Die Menge an Hilfsstoffen, die zur Synthese oder zur Aufarbeitung eingesetzt wurden, sind uninteressant. Vollkommen andere Argumente gelten, wenn ein Reaktionsprodukt marktfähig sein soll. Hier steht der Gesamtaufwand im Mittelpunkt.
- Eine Synthese kann auch dann marktfähig sein, wenn viele Produkte entstehen, wenn man diese gut trennen und alle weiterverwenden oder verkaufen kann.
- Eine Synthese kann marktfähiger sein, wenn man die Gleichgewichtseinstellung nicht abwartet, wenn die erst bei zu langer Reaktionszeit und entsprechendem Aufwand (z.B. Heizenergie) erreicht ist.
- Eine Synthese, deren Produkt chromatographisch aufgearbeitet werden muss, ist wegen des damit verbundenen Aufwandes kaum marktfähig - es sein denn es handelt sich um Spezialchemikalien, die man entsprechend teuer verkaufen kann.
Chemische Unternehmen versuchen, ein Maximum an Syntheseerfolg mit minimalem Aufwand zu erreichen. Da der merkantile Aufwand in der Regel durch einen entsprechenden Ressourcenaufwand entsteht, ist eine finanzkalkulatorisch erfolgreiche Synthese oft auch eine, die unter umweltschonenden Bedingungen abläuft. Es gibt folgende ökologische Kenngrößen:
Massenbilanz
Bei der hier betrachteten Reaktion wurden insgesamt 176,3 g an Ausgangsmaterialien eingesetzt, aber nur 13 g Ausbeute erzielt. Die verbleibenden 176,3 - 13 = 163,3 g sind nicht verschwunden, sondern sie sind Abfall, der vor allem im Forschungslabor nicht aufgearbeitet sondern weggeworfen wird. Dieser fast schon grotesk anmutende Materialaufwand ist in Wahrheit noch größer, weil
- die Hilfsreagentien für die Aufreinigung des Produkts noch gar nicht eingerechnet sind (z.B. Lösemittel zum Umkristallisieren.) und weil
- das Benzaldehyd-diacetat im Regelfall noch gar nicht das Endprodukt ist, sondern der freie Aldehyd, weshalb die Schutzgruppen in einer Folgereaktion noch abgespalten werden müssen. (Gelänge diese Reaktion mit einer Ausbeute von 100 %, so würden gerade mal 6,5 g Benzaldehyd erhalten werden.)
Fazit
Stellt man Benzaldehyd auf diesem Wege her, so ist mehr als das 20-fache an Ausgangsmaterialien notwendig!
"Akademisch" ist das nicht der Rede Wert, ökonomisch und ökologisch hingegen ein großes Problem! Dabei ist noch nicht mal die Art des Abfalls berücksichtigt, bei dem es sich hier z.T. um ein Schwermetallsalz handelt.
Atomökonomie
Darunter wird der prozentuale Massenanteil des Produkts, bezogen auf die gesamte Masse aller eingesetzten Reaktanden bei stöchiometrischem Umsatz verstanden. Dazu zunächst noch einmal ein Blick auf die Reaktionsgleichung:
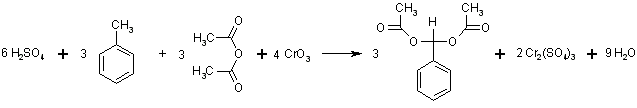
Es sind also umzusetzen:
| 6 mol Schwefelsäure | 6*98,08 | = | 588 g |
| 3 mol Toluol | 3*92,14 | = | 276 g |
| 3 mol Acetanhydrid | 3*74,08 | = | 222 g |
| 4 mol Chromtrioxid | 4*99,99 | = | 400 g |
| Summe | 1486 g | ||
| Es werden erhalten: | |||
| 3 mol Benzaldehyd-diacetat | 3*208,22 | = | 625 g |
Die Atomökonomie beträgt also 625 : 1486 =
42 %
Die Atomökonomie ist nicht mehr und nicht weniger als eine ganz simple Kenngröße zur Beschreibung der Effektivität einer Reaktion. Sie berücksichtigt nicht,
- dass die reale Massenbilanz durch überschüssig verwendete Reagentien sowie durch nicht in der Reaktionsgleichung auftretende Hilfsstoffe im Regelfall deutlich schlechter ist,
- ob erhaltene Nebenprodukte tatsächlich Abfall sind, oder aufgereinigt und anderweitig verwendet, bzw. in dem Prozess erneut eingesetzt werden können und
- ob es sich bei den Nebenprodukten um einfach zu entsorgende oder im Gegenteil hochproblematische Abfälle handelt.
Technische Verfahren
Es gibt diverse weitere Labormethoden, mit denen man aus Toluol Benzaldehyd herstellen könnte (z.B. Oxidation nach Swern) Alle diese Verfahren haben den Nachteil, dass auch Abfall entsteht.
Technisch wird Benzaldehyd deshalb u.a. durch katalytische Oxidation von Toluol durch Luftsauerstoff gewonnen. Man muss die Reaktionsgleichung dazu nicht formulieren, um zu erkennen, dass die Atomökonomie hier 100 % beträgt. Allerdings hat die Reaktion einen für die Verwendung im Labor schweren Nachteil: Außer Benzaldehyd wird ebenfalls - und sogar überschüssig - Benzoesäure erhalten. Industriell macht das wiederum gar nichts, weil auch die Benzoesäure sich gut vermarkten lässt.

