Ausbeuteberechnung
Reaktionsbeispiel:
Eine an ein aromatisches System gebundene Methylgruppe lässt sich mit Chromtrioxid oxidieren. Normalerweise wird dabei die Oxidationsstufe des Aldehyds übersprungen und man erhält die Carbonsäure. Fängt man intermediär gebildeten Aldehyd als Diacetat ab, bleibt die Oxidationsreaktion auf dieser Stufe stehen. Die Reaktion erfolgt in schwefelsaurer Lösung nach folgendem Schema:
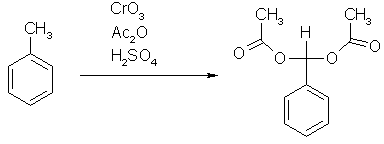
Eine gegebene Vorschrift nennt den folgenden Ansatz:
| Acetanhydrid: | 100 ml |
| Toluol: | 8,3 g |
| konz. Schwefelsäure: | 20 ml |
| Chromtrioxid: | 25 g |
Wenn bei der Reaktion eine Ausbeute von 13 g des Diacetats erhalten wurde: Wie viel Prozent der theoretisch möglichen Ausbeute wären das?
Stellen Sie sich auch bei den weiteren Überlegungen die stöchiometrisch reagierenden Moleküle vor!
Man benötigt dazu als erstes die stöchiometrische Reaktionsgleichung:
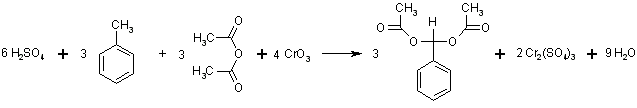
Es reagieren also:
 |
 |
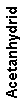 |
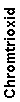 |
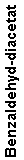 |
||
| Moleküle | 6 | 3 | 3 | 4 | zu | 3 |
| Also auch Mole | 6 | 3 | 3 | 4 | zu | 3 |
| Wenn man die Molzahlen durch die stöchiometrischen Koeffizienten teilt, erhät man Äquivalente. | ||||||
| Äquivalente | 6:6=1 | 3:3=1 | 3:3=1 | 4:4=1 | 3:3=1 | |
Die letzte Zeile sieht ziemlich banal aus, weil überall 1 herauskommt.
Bedenken Sie, dass das ein Idealfall ist, bei dem
- alle Moleküle im exakten stöchiometrischen Verhältnis eingesetzt werden
- jedes Molekül vollständig abreagiert und
- ausschließlich das gewünschte Produkt - und zwar zu 100 % gebildet wird.
Bei realen Versuchsansätzen
- werden Reaktanden oft nicht in exakt stöchiometrischem Verhältnis eingesetzt, z.B. weil man durch Überschuss des einen Reaktanden die Ausbeute hinsichtlich des anderen Reaktanden verbessern will
- werden nicht 100 % Produktausbeute erhalten.
Bei einem realen Versuchsansatz gilt es also, zuerst die limitierende Komponente zu bestimmen.
Das ist die unterschüssig eingesetzte Komponente. Machen Sie sich klar:
- Wenn alle Moleküle der unterschüssig eingesetzten Komponente reagiert haben, kann kein weiteres Produkt mehr gebildet werden - auch wenn Tonnen der anderen Reaktionspartner noch auf eine Reaktion warten.
Es wäre ein Fehler, die Ausbeute einer Reaktion immer auf das eingesetzte organische Substrat zu beziehen, bloß weil es sich um ein organisch-chemisches Praktikum handelt. Es ist zwar häufig so, dass die Reagenzien zur Umwandlung eines organischen Substrats überschüssig eingesetzt werden, aber das muss keineswegs immer der Fall sein.
Es müssen zur Berechnung alle Einwaagen in Gramm vorliegen.
Das Problem des Reaktionsansatzes liegt zunächst einmal darin, dass nicht alle Reaktanden in Gramm angegeben sind und die Reaktanden nicht alle mit einem 100 %igen Gehalt vorliegen. Es ist also wie folgt umzurechnen:
Ansatzumrechnung:
| Stoff | eingesetzt | spez. Gewicht g/ml |
Masse g |
Gehalt % |
Masse des reinen Stoffs g |
| Acetanhydrid | 100 ml | 1,08 | 108 | 108 | |
| Toluol | 8,3 g | 8,3 | 8,3 | ||
| konz. Schwefelsäure | 20 ml | 1,84 | 37 | 96 | 35 |
| Chromtrioxid | 25 g | 25 | 25 | ||
| Man mag darüber streiten, ob es notwendig ist, die Menge der Schwefelsäure um den Gehalt zu korrigieren, weil sie ja "fast" 100%ig ist. Hier geht es aber zumindest didaktisch darum den Formalismus, der bei Reagentien mit einer Prozentangabe einzuhalten ist, an diesem Beispiel aufzuzeigen. Auch diverse andere Reagentien haben übrigens einen vom Hersteller garantierten Reinheitsgrad, "Acetanhydrid zur Synthese" von Merck z.B. "> 98%". Beachten Sie schließlich, dass es etliche Reagentien gibt, die zersetzlich sind, also nach längerem Stehen lassen Gehalte weit unter 90 % haben können! | |||||
Wir finden jetzt die unterschüssig eingesetzte Komponente
Nach der Formel n=m/M können nun die eingesetzten Molmengen und die Äquivalente berechnet werden. Da der Ansatz labortypisch klein ist, werden nur milli-Äquivalente erhalten. Beachten Sie, dass die Äquivalente erhalten werden, indem die eingesetzten Molmengen durch die stöchiometrischen Koeffizienten dividiert werden:
| Stoff | Masse g |
Molmasse g/mol |
Molmenge | Äquivalente |
| Acetanhydrid | 108 | 74,08 | 1,46 mol | 486 mäquiv. |
| Toluol | 8,3 g | 92,14 | 90 mmol | 30 mäquiv. |
| konz. Schwefelsäure | 35 | 98,08 | 360 mmol | 60 mäquiv. |
| Chromtrioxid | 25 g | 99,99 | 250 mmol | 63 mäquiv. |
Bitte beachten Sie folgendes:
|
||||
Nach den Ergebnissen vorstehender Berechnungen liegt ganz offensichtlich das Toluol im Unterschuss vor. Dies ist für Oxidationsreaktionen typisch, aber noch einmal: Es muss nicht immer so sein, dass das organische Substrat im Unterschuss vorliegt.
Das Toluol limitiert also in diesem Fall die Ausbeute. Es kann kein weiteres Produkt gebildet werden, wenn alles Toluol verbraucht worden ist.
Die Produktmenge wird zur limitierenden Komponente ins Verhältnis gesetzt.
Nach den Vorgaben wurden 13 g des Diacetats erhalten, die sich wie folgt in Äquivalente umrechnen lassen:
| Stoff | Auswaage g |
Molmasse g/mol |
Molmenge | Äquivalente |
| Benzaldehyd-diazetat | 13 g | 208,22 | 62 mmol | 21 mäquiv |
Da das Toluol mit einer eingesetzten Menge von 30 Milliäquivalenten limitierend war, hätte eine Menge von 30 Milliäquivalenten des Benzaldehyd-Diacetats einer Ausbeute von 100 % entsprochen. Da aber nur 21 Milliäquivalente erhalten wurden, entspricht das einer Ausbeute von 21/30 =
70 %
Denkweisen außerhalb des akademischen Elfenbeinturms
Aus akademischer Sicht zählt grundsätzlich nur die Ausbeute bezogen auf die Menge des eingesetzten Edukts. Eine hohe Ausbeute ist ein Hinweis auf eine glatt verlaufende Reaktion, die das Substrat "gut übersteht" ohne sich zu zersetzen oder Nebenreaktionen einzugehen. Die Menge an Hilfsstoffen, die zur Synthese oder zur Aufarbeitung eingesetzt wurden, sind uninteressant. Vollkommen andere Argumente gelten, wenn ein Reaktionsprodukt marktfähig sein soll. Hier steht der Gesamtaufwand im Mittelpunkt.
- Eine Synthese kann auch dann marktfähig sein, wenn viele Produkte entstehen, wenn man diese gut trennen und alle weiterverwenden oder verkaufen kann.
- Eine Synthese kann marktfähiger sein, wenn man die Gleichgewichtseinstellung nicht abwartet, wenn die erst bei zu langer Reaktionszeit und entsprechendem Aufwand (z.B. Heizenergie) erreicht ist.
- Eine Synthese, deren Produkt chromatographisch aufgearbeitet werden muss, ist wegen des damit verbundenen Aufwandes kaum marktfähig - es sein denn es handelt sich um Spezialchemikalien, die man entsprechend teuer verkaufen kann.
Chemische Unternehmen versuchen, ein Maximum an Syntheseerfolg mit minimalem Aufwand zu erreichen. Da der merkantile Aufwand in der Regel durch einen entsprechenden Ressourcenaufwand entsteht, ist eine finanzkalkulatorisch erfolgreiche Synthese oft auch eine, die unter umweltschonenden Bedingungen abläuft. Es gibt folgende ökologische Kenngrößen:
Massenbilanz
Bei der hier betrachteten Reaktion wurden insgesamt 176,3 g an Ausgangsmaterialien eingesetzt, aber nur 13 g Ausbeute erzielt. Die verbleibenden 176,3 - 13 = 163,3 g sind nicht verschwunden, sondern sie sind Abfall, der vor allem im Forschungslabor nicht aufgearbeitet sondern weggeworfen wird. Dieser fast schon grotesk anmutende Materialaufwand ist in Wahrheit noch größer, weil
- die Hilfsreagentien für die Aufreinigung des Produkts noch gar nicht eingerechnet sind (z.B. Lösemittel zum Umkristallisieren.) und weil
- das Benzaldehyd-diacetat im Regelfall noch gar nicht das Endprodukt ist, sondern der freie Aldehyd, weshalb die Schutzgruppen in einer Folgereaktion noch abgespalten werden müssen. (Gelänge diese Reaktion mit einer Ausbeute von 100 %, so würden gerade mal 6,5 g Benzaldehyd erhalten werden.)
Fazit
Stellt man Benzaldehyd auf diesem Wege her, so ist mehr als das 20-fache an Ausgangsmaterialien notwendig!
"Akademisch" ist das nicht der Rede Wert, ökonomisch und ökologisch hingegen ein großes Problem! Dabei ist noch nicht mal die Art des Abfalls berücksichtigt, bei dem es sich hier z.T. um ein Schwermetallsalz handelt.
Atomökonomie
Darunter wird der prozentuale Massenanteil des Produkts, bezogen auf die gesamte Masse aller eingesetzten Reaktanden bei stöchiometrischem Umsatz verstanden. Dazu zunächst noch einmal ein Blick auf die Reaktionsgleichung:
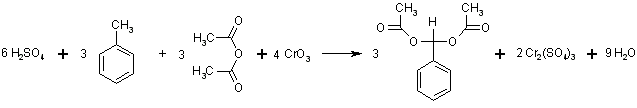
Es sind also umzusetzen:
| 6 mol Schwefelsäure | 6*98,08 | = | 588 g |
| 3 mol Toluol | 3*92,14 | = | 276 g |
| 3 mol Acetanhydrid | 3*74,08 | = | 222 g |
| 4 mol Chromtrioxid | 4*99,99 | = | 400 g |
| Summe | 1486 g | ||
| Es werden erhalten: | |||
| 3 mol Benzaldehyd-diacetat | 3*208,22 | = | 625 g |
Die Atomökonomie beträgt also 625 : 1486 =
42 %
Die Atomökonomie ist nicht mehr und nicht weniger als eine ganz simple Kenngröße zur Beschreibung der Effektivität einer Reaktion. Sie berücksichtigt nicht,
- dass die reale Massenbilanz durch überschüssig verwendete Reagentien sowie durch nicht in der Reaktionsgleichung auftretende Hilfsstoffe im Regelfall deutlich schlechter ist,
- ob erhaltene Nebenprodukte tatsächlich Abfall sind, oder aufgereinigt und anderweitig verwendet, bzw. in dem Prozess erneut eingesetzt werden können und
- ob es sich bei den Nebenprodukten um einfach zu entsorgende oder im Gegenteil hochproblematische Abfälle handelt.
Technische Verfahren
Es gibt diverse weitere Labormethoden, mit denen man aus Toluol Benzaldehyd herstellen könnte (z.B. Oxidation nach Swern) Alle diese Verfahren haben den Nachteil, dass auch Abfall entsteht.
Technisch wird Benzaldehyd deshalb u.a. durch katalytische Oxidation von Toluol durch Luftsauerstoff gewonnen. Man muss die Reaktionsgleichung dazu nicht formulieren, um zu erkennen, dass die Atomökonomie hier 100 % beträgt. Allerdings hat die Reaktion einen für die Verwendung im Labor schweren Nachteil: Außer Benzaldehyd wird ebenfalls - und sogar überschüssig - Benzoesäure erhalten. Industriell macht das wiederum gar nichts, weil auch die Benzoesäure sich gut vermarkten lässt.



