Abgeschlossene Forschung: Signaltransduktion
- Signaltransduktion - Dictyostelium discoideum
- Calcineurin
- Signaltransduktion - Evolution von Signaltransduktionswegen
Signaltransduktion - Dictyostelium discoideum
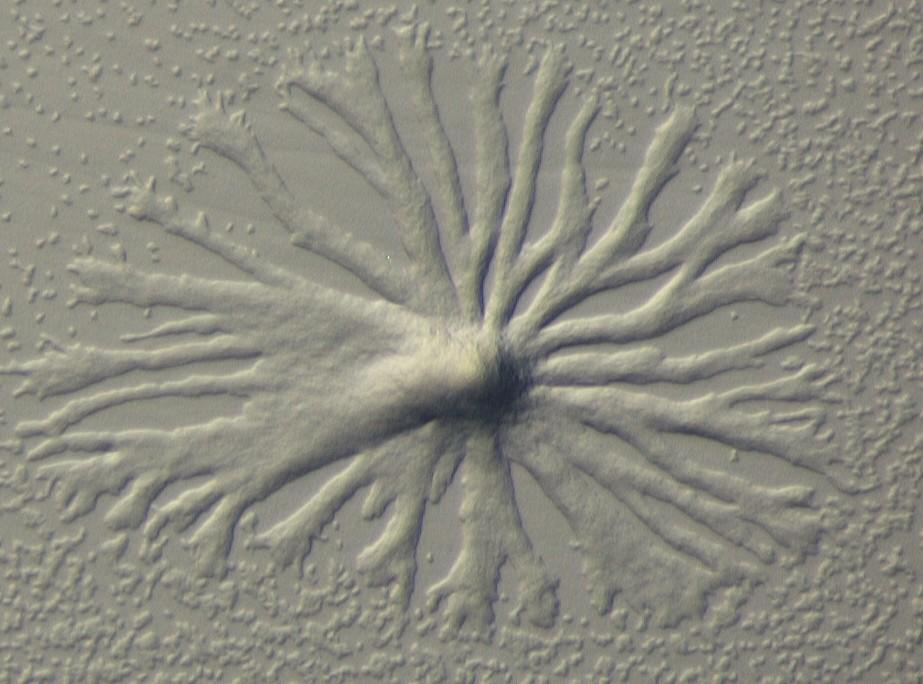 Dictyostelium discoideum
Dictyostelium discoideum
Zelluläre Schleimpilze (soziale Amöben) sind eine Gruppe eukaryontischer Bodenmikroorganismen, die man überall in den gemäßigten Klimazonen finden kann. Es sind etwa 100 Arten beschrieben, von den primitiven Guttulinopsis bis zu den komplex gebauten Polysphondylien. Es gibt sogar eine räuberische Art, Dictyostelium caveatum, die Zellen anderer Arten fressen kann.
Soziale Amöben wachsen in ihrer vegetativen Phase als einzellige Amöben auf anderen Bodenmikroben, die phagozytiert werden. Unter Laborbedingungen muss eine Zelle von Dictyostelium discoideum etwa 1000 Zellen des Bakteriums Escherichia coli fressen, bevor sie sich teilen kann. Wenn das Verhältnis zwischen der Menge an verfügbarer Nahrung und Amöbendichte einen kritischen Wert erreicht, beginnen die Zellen einen Entwicklungsprozess, in dessen Verlauf aus einer Population individueller Amöben ein echter vielzelliger Organismus aus zwei klar definierten Geweben mit differenzierten Zellen entsteht, toten Stielzellen und keimungsfähigen Sporen.
Soziale Amöben sind Modellorganismen, an denen eine Reihe interessanter Fragen studiert werden können: Phagozytose, Übergang vom Wachstum der Population zur Differenzierung individueller Zellen, Regulation der Gewebegröße, Zellbewegung und Zytoskelett, Chemotaxis und Signaltransduktion, Zellkontakte, morphogenetische Zellbewegungen, "programmierter" Zelltod. Eine Art, Dictyostelium discoideum, ist zum Modell für die ganze Organismengruppe geworden, entsprechend werden etwa 95% aller Arbeiten an diesem "Modell für das Modell" durchgeführt. Seit der Bestimmung der DNA Sequenz des Genoms vor einigen Jahren sind molekulargenetische Untersuchungen noch einfacher geworden.
Entwicklung von Dictyostelium
Während der Entwicklung laufen bis zu 100000 individuelle Zellen durch Chemotaxis in einem Aggregat zusammen, das sich in eine nacktschneckenähnliche, polare Struktur umwandelt und von einer extrazellulären Matrix (der "Schleimhülle") umgeben ist. Dieser "Slug" kann sich nun auf die Suche nach günstigen Bedingungen für die Ausbildung des Sporenträgers machen und wird bei seiner Wanderung durch äußere Reize wie Temperatur oder Licht geleitet. Bei der Kulmination zum reifen Fruchtkörper stellt sich die Spitze des Zellverbands, in der die zukünftigen Stielzellen versammelt sind, senkrecht zum Substrat und die differenzierenden Stielzellen wandern in einer morphogenetischen Zellbewegung, die an die Gastrulation bei den Embryonen höherer Organismen erinnert, durch die Masse der zukünftigen Sporenzellen zur Basis. Dabei differenzieren sie terminal zu reifen Stielzellen, die sich nicht mehr vermehren können. Die künftigen Sporenzellen werden mit dem Längenwachstum des Stiel nach oben gehoben und bilden ein rundes Köpfchen aus reifen Sporen, die gegen Umwelteinflüsse resistent sind und von denen jede einzelne einen neuen Zyklus beginnen kann.
Calcineurin
Die Proteinphosphatase Calcineurin ist von der Hefe bis zum Menschen konserviert (mit Ausnahme der Pflanzen). Sie spielt eine wichtige Rolle in vielen Signaltransduktionswegen wie z.B. der Immunantwort oder der vielzelligen Entwicklung.
Auch bei unserem Forschungsobjekt Dictyostelium discoideum ist Calcineurin an der Regulation der Entwicklung beteiligt. So zeigt sich bei Mutanten, bei denen die Expression der regulatorischen Untereinheit mittels RNAi vermindert wurde, eine veränderte Morphologie der Fruchtkörper mit stark verkürzten Stielen (Böckeler et al., 2006, BMC Dev Biol).
Aktuelle Forschungsarbeiten unserer Arbeitsgruppe befassen sich mit der Funktion der katalytischen Untereinheit von Calcineurin sowie mit den Zielproteinen dieser wichtigen Phosphatase.
Signaltransduktion - Evolution von Signaltransduktionswegen
Evolution von interzellulärer Kommunikation und Vielzelligkeit
 Aus vergleichender Sicht gibt es eine ganze Reihe interessanter morphologischer und entwicklungsbiologischer Adaptationen bei den ursprünglich als zellulären Schleimpilzen klassifizierten Organismen. So ist Protostelium nicht wirklich vielzellig, da eine einzige Zelle einen kleinen Zellulosestiel bilden kann, auf dem eine Spore sitzt. Bei Acytostelium besteht der Stiel aus einem "Zelluloseschlauch", die Entwicklung führt also nicht zum Tod einer Subpopulation des Aggregats. Das "Acrasin" (also die chemoaktive Substanz, welche die Aggregation koordiniert) ist bei Acytostelium noch unbekannt. Bei den "kleinen" Dictyostelium Arten wie D. minutum und D. lacteum wurden diese Acrasine als Pterin-Derivate identifiziert. Der Pterin-Abkömmling Folsäure ist übrigens bei allen untersuchten Arten ein Signal, das die Anwesenheit von Futterbakterien anzeigt. D. minutum wie D. lacteum bilden Fruchtkörper mit einem zellulären Stiel, sie müssen also einen Teil der Zellen, die am "sozialen Abenteuer" teilnehmen, für die Fruchtkörperbildung opfern. Bei den komplexeren Dictyostelium und Polysphondylium Arten kann der Anteil an Zellen, die bei der Stielbildung sterben, zwischen 20 und 90% schwanken. Die Aggregation wird bei Dictyostelium discoideum und seinen Verwandten durch zyklisches AMP koordiniert, das als intrazellulärer "second messenger" bekannt geworden ist. Bei Polysphondylium ist das chemotaktische Agens ein Peptidderivat. Einen bemerkenswerten Lebensstil zeigt Dictyostelium caveatum, "der Wolf unter den zellulären Schleimpilzen". Die Art wurde von D. Waddell entdeckt, als er verschiedene Spezies mischte, um herauszufinden, welches Acrasin sie verwenden (D. caveatum verwendet Glorin und ist daher wohl eher den Polysphondylien zuzuordnen). Erstaunlich war, dass bei jeder Mischung mit D. caveatum nur dieser übrigblieb. Zellen von D. caveatum invadieren Aggregate von Zellen anderer Spezies und "fressen sie von innen her auf". Wenn die verfügbare Menge an Beuteamöben kritisch wird, beginnt der Räuber mit seiner Entwicklung und seine Fruchtkörper brechen am Ende durch die Schleimhülle seines Opfers. Diese Adaptation ans räuberische Leben muß D. caveatum offenbar mit dem Verlust zumindest eines Teils seines Selbst/Nichtselbst-Erkennungssystems erkaufen: man kann sehr leicht kannibalistische Mutanten von D. caveatum isolieren.
Aus vergleichender Sicht gibt es eine ganze Reihe interessanter morphologischer und entwicklungsbiologischer Adaptationen bei den ursprünglich als zellulären Schleimpilzen klassifizierten Organismen. So ist Protostelium nicht wirklich vielzellig, da eine einzige Zelle einen kleinen Zellulosestiel bilden kann, auf dem eine Spore sitzt. Bei Acytostelium besteht der Stiel aus einem "Zelluloseschlauch", die Entwicklung führt also nicht zum Tod einer Subpopulation des Aggregats. Das "Acrasin" (also die chemoaktive Substanz, welche die Aggregation koordiniert) ist bei Acytostelium noch unbekannt. Bei den "kleinen" Dictyostelium Arten wie D. minutum und D. lacteum wurden diese Acrasine als Pterin-Derivate identifiziert. Der Pterin-Abkömmling Folsäure ist übrigens bei allen untersuchten Arten ein Signal, das die Anwesenheit von Futterbakterien anzeigt. D. minutum wie D. lacteum bilden Fruchtkörper mit einem zellulären Stiel, sie müssen also einen Teil der Zellen, die am "sozialen Abenteuer" teilnehmen, für die Fruchtkörperbildung opfern. Bei den komplexeren Dictyostelium und Polysphondylium Arten kann der Anteil an Zellen, die bei der Stielbildung sterben, zwischen 20 und 90% schwanken. Die Aggregation wird bei Dictyostelium discoideum und seinen Verwandten durch zyklisches AMP koordiniert, das als intrazellulärer "second messenger" bekannt geworden ist. Bei Polysphondylium ist das chemotaktische Agens ein Peptidderivat. Einen bemerkenswerten Lebensstil zeigt Dictyostelium caveatum, "der Wolf unter den zellulären Schleimpilzen". Die Art wurde von D. Waddell entdeckt, als er verschiedene Spezies mischte, um herauszufinden, welches Acrasin sie verwenden (D. caveatum verwendet Glorin und ist daher wohl eher den Polysphondylien zuzuordnen). Erstaunlich war, dass bei jeder Mischung mit D. caveatum nur dieser übrigblieb. Zellen von D. caveatum invadieren Aggregate von Zellen anderer Spezies und "fressen sie von innen her auf". Wenn die verfügbare Menge an Beuteamöben kritisch wird, beginnt der Räuber mit seiner Entwicklung und seine Fruchtkörper brechen am Ende durch die Schleimhülle seines Opfers. Diese Adaptation ans räuberische Leben muß D. caveatum offenbar mit dem Verlust zumindest eines Teils seines Selbst/Nichtselbst-Erkennungssystems erkaufen: man kann sehr leicht kannibalistische Mutanten von D. caveatum isolieren.
Die Diversität der chemotaktischen Systeme läßt ein plausibles Modell für ihre Evolution und die der ganzen Organismengruppe zu: Danach könnte ein ursprünglich für die Futtersuche verwendetes Signal (Folsäure) Grundlage für die Evolution eines Pterin-"Hormonsystems" sein (D. minutum, D. lacteum), das auf der nächsten Stufe von der Verwendung eines ursprünglich intrazellulären Botenstoffs, cAMP, abgelöst wird (Dictyostelium sensu stricto) und schließlich bei Polyspondylium von einem "noblen" Peptid-Signal, das nun nur noch diesem Zweck dient (Mutzel, R. (1991): Cellular slime molds: Why and how to become pluricellular? Bull. Inst. Pasteur 89, 51-56).
Dieses Evolutionsmodell ist vor ein paar Jahren in einer Zusammenarbeit mit mehreren Arbeitsgruppen in Deutschland, Großbritannien und den USA durch Analysen zur molekularen Phylogenie von ribosomalen RNA- und Proteinsequenzen überprüft worden und es hat sich als falsch herausgestellt - um ein Wort aus der schönen Doppelseite über Dictyostelium in der Frankfurter Allgemeinen Sonntagszeitung vom 17.7.2005 aufzugreifen (Friebe, R., Weissenmayer, B.: "Zellen, hört die Signale"): Manchmal ist man vorher klüger...(Schaap et al., 2006, Science) Der letzte gemeinsame Vorfahr der modernen sozialen Amöben war nämlich bereits vielzellig, er kommunizierte mit einem Peptidsignal, das sich vielleicht von einem ursprünglich als antibiotische Substanz sezenierten Peptid ableitet und ein Teil der Zellen im Organismus differenzierte zu Stielzellen. Der azelluläre Stiel bei Acytostelium Spezies ist deshalb sekundär entstanden.
Derzeit werden die Genomsequenzen von mehreren Vertretern der molekular definierten Gruppen von sozialen Amöben bestimmt. Diese Daten werden weiteren Einblick in die Evolution von Zellkommunikation und Vielzelligkeit bei dieser Organismengruppe erlauben.